


Die Umsetzung der Europäischen Verordnung über In-Vitro-Diagnostika (IVDR 2017/746/EU) ist bei Immundiagnostik in vollem Gange. Unser Unternehmen hat bereits vor einiger Zeit Wege beschritten, um die gegenwärtige und zukünftige Verfügbarkeit unserer Produkte unter der neuen Verordnung sicherzustellen.
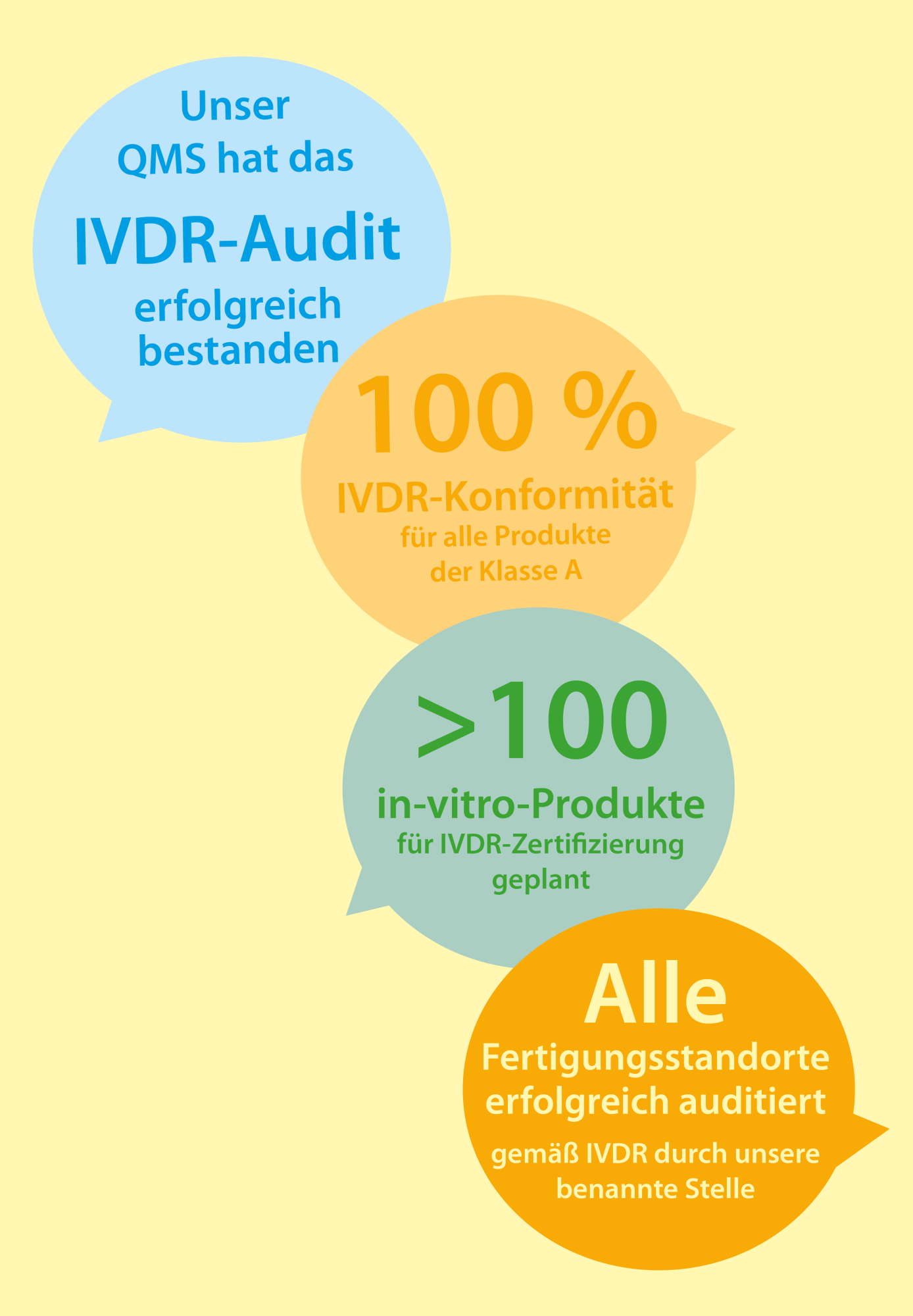
Wir halten Sie weiterhin über die aktuellen Entwicklungen auf dem Laufenden!