


Der menschliche Darm mit seinen ca. 8-9 Metern Länge und etwa 200 m² Fläche ist die größte Schnittstelle zwischen externer und interner Umgebung. Ein wichtiger Bestandteil des Darms ist das Darmepithel, ein einschichtiger Zellverband. Seine Hauptaufgaben sind die Sekretion und Resorption. Unter Sekretion versteht man die Produktion von Verdauungsenzymen (wie beispielsweise Maltasen oder Saccharasen) oder auch Schleim, dem Mukus. Die Resorption ist die Aufnahme von Nahrungsbestandteilen in den Blutkreislauf. Neben der Sekretion und Resorption ist die Barrierefunktion eine essentielle Aufgabe des Darmepithels, durch die eine stark regulierte Durchlässigkeit (Permeabilität) gewährleistet wird.
Grundsätzlich kann die intestinale Barrierefunktion in drei Ebenen aufgeteilt werden:
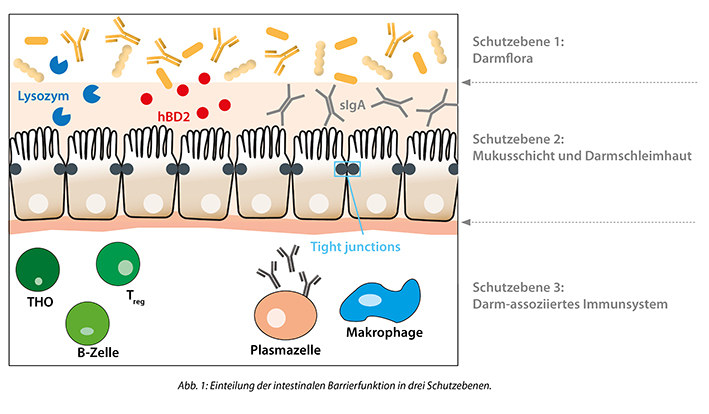
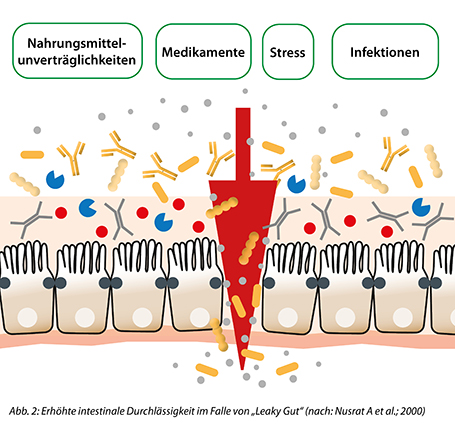
Ist die Darmbarriere gestört, erhöht sich die Durchlässigkeit des Epithels und man spricht von einem „Leaky Gut“. Dies kann durch verschiedenste Auslöser hervorgerufen werden. Beispielsweise können die Einnahme bestimmter Medikamente (z. B. Antibiotika) die intestinale Exposition mit toxischen Metallen oder auch Infektionen einen Leaky Gut begünstigen. Ebenso gibt es einen Zusammenhang zwischen Alkoholkonsum, Nahrungsmittelunverträglichkeiten oder Stress mit dem Auftreten eines Leaky Guts.
Durch die erhöhte Durchlässigkeit des Darms gelangen Nahrungsmittelbestandteile, kommensale bzw. pathogene Mikroorganismen oder auch Toxine in den Blutkreislauf, wodurch systemische Entzündungen hervorgerufen werden können. Typische Symptome in diesem Zusammenhang sind andauernde Durchfälle und Blähungen, allgemeine Reizdarmbeschwerden, Nahrungsmittelallergien und -intoleranzen. Jedoch können auch eher Darm-untypische Symptome wie Müdigkeit und Schlappheit ein Indiz für einen Leaky Gut sein. Es gibt eine Vielzahl an wissenschaftlichen Veröffentlichungen, die einen Leaky Gut mit der Entstehung von Folgeerkrankungen, wie beispielweise chronischen Entzündungen oder auch Autoimmunerkrankungen, in Verbindung bringt.
Durch die unterschiedliche Ausprägung der Symptome ist eine Diagnose mit Leaky Gut für die Patienten oft eine langwierige Angelegenheit. Die Immundiagnostik AG bietet ein breites Portfolio mit wissenschaftlich fundierten Biomarkern, die im Zusammenhang mit der Diagnose Leaky Gut untersucht werden können.
Erfahren Sie mehr in unserem nächsten Beitrag (Part 2) über diagnostische Möglichkeiten im Zusammenhang mit Leaky Gut.
Referenzen:
・ Camilleri, M. (2019). Leaky gut: mechanisms, measurement and clinical implications in humans. Gut, 68(8), 1516-1526. https://doi.org/10.1136/gutjnl-2019-318427
・ Fasano, A. (2020). All disease begins in the (leaky) gut: role of zonulin-mediated gut permeability in the pathogenesis of some chronic inflammatory diseases. F1000Res, 9. https://doi.org/10.12688/f1000research.20510.1
・ Vanuytsel, T., Tack, J., & Farre, R. (2021). The Role of Intestinal Permeability in Gastrointestinal Disorders and Current Methods of Evaluation. Front Nutr, 8, 717925. https://doi.org/10.3389/fnut.2021.717925
・ Nusrat, A., Turner, J. R., & Madara, J. L. (2000). Molecular physiology and pathophysiology of tight junctions. IV. Regulation of tight junctions by extracellular stimuli: nutrients, cytokines, and immune cells. American journal of physiology. Gastrointestinal and liver physiology, 279(5), G851–G857. https://doi.org/10.1152/ajpgi.2000.279.5.G851