


In unserem zweiten Blog Post der Reihe haben wir über die diagnostischen Möglichkeiten der epithelialen Barriere berichtet. Hierbei spielen besonders die Biomarker Zonulin, α1-Antitrypsin und FABP2 eine wichtige Rolle. Neben Diagnosemöglichkeiten der epithelialen Barriere haben sich im Zusammenhang mit Leaky Gut einige Parameter etabliert, die den immunologischen Barrierestatus des Darmes widerspiegeln.
Sekretorisches IgA ist ein Immunglobulin, welches von den in der Lamina propria gelegenen Plasmazellen gebildet wird und eine entscheidende Rolle bei der Immunfunktion von Schleimhäuten spielt. sIgA dient als erste Verteidigungslinie der Schleimhäute gegen pathogene Keime, Toxine und Allergene. Bei gesunden Menschen überzieht das sIgA die Schleimhäute mit einer durchgehenden Schutzschicht und kommt daher in Körpersekreten wie Speichel, Tränen, Nasenschleim, Tracheobronchialschleim, Kolostrum und Muttermilch, gastrointestinalen Sekreten und Stuhl vor. sIgA besteht aus zwei IgA-Monomeren, die durch eine J-Kette („j“ für „joining“) miteinander verbunden sind. Zusätzlich besitzt sIgA eine sogenannte sekretorische Komponente, auch SC-Kette genannt. Diese ermöglicht den Transport durch die Epithelzellen und stabilisiert sIgA. Aufgrund dieser besonderen Struktur wird sIgA im Gegensatz zu IgA nicht durch Enzyme abgebaut. Daher ist die Bestimmung von sIgA im Stuhl für die Diagnostik sehr gut geeignet. Die Bestimmung von sIgA mit dem IDK® sIgA ELISA (K 8870, 1-Punkt-Kalibration K 8880) im Stuhl gibt Auskunft über den Stimulationsgrad sowie die Sekretionsleistung der in der Lamina propria des Intestinums gelegenen Plasmazellen und lässt daher Rückschlüsse auf den Zustand der immunologischen Barriere der Darmschleimhaut zu. Ein Mangel an sIgA deutet auf eine verminderte Aktivität des intestinalen Immunsystems hin, wogegen erhöhte sIgA-Werte auf eine erhöhte Aktivität und somit auf eine lokale Entzündung der Darmschleimhaut hinweisen. (Brandtzaeg, 1981; Strugnell & Wijburg, 2010)
Liegt kein Immundefekt vor, sind geringe sIgA-Konzentrationen ein Hinweis für eine erhöhte intestinale Permeabilität durch eine nicht funktionstüchtige immunologische Barriere.
Eine weitere bedeutende Komponente des immunologischen Schutzes im Darm sind Defensine, körpereigene antimikrobielle Peptide. Bei diesen Molekülen handelt es sich um kleine kationische Peptide, die sich in der Struktur ähneln und immer drei intramolekulare Disulfidbrücken ausbilden, wodurch ihre charakteristische β-Faltblattstruktur stabilisiert wird. Diese Struktur bedingt eine amphiphile Ladungsverteilung, die den Defensinen die Interaktion mit der Targetzellmembran erlaubt und somit eine Porenbildung in der äußeren Zellmembran, die Lyse und eventuell den Tod der Zelle verursachen kann. Menschliche β-Defensine-1 (hBD-1), 2, 3, und 4 werden von verschiedenen Epithelzellen exprimiert. Die normale Darmmukosa exprimiert hBD-1, während hBD-2 und hBD-3 nur bei einer Entzündung gebildet werden. Liegt eine verminderte β-Defensin-Expression in Stuhlproben vor (β-Defensin 2 ELISA K 6500), kommt es zu einer eingeschränkten Barrierefunktion der Darmschleimhaut, welche eine vermehrte Invasion von Bakterien zulässt. (Ganz & Lehrer, 1994; Hill et al., 1991)
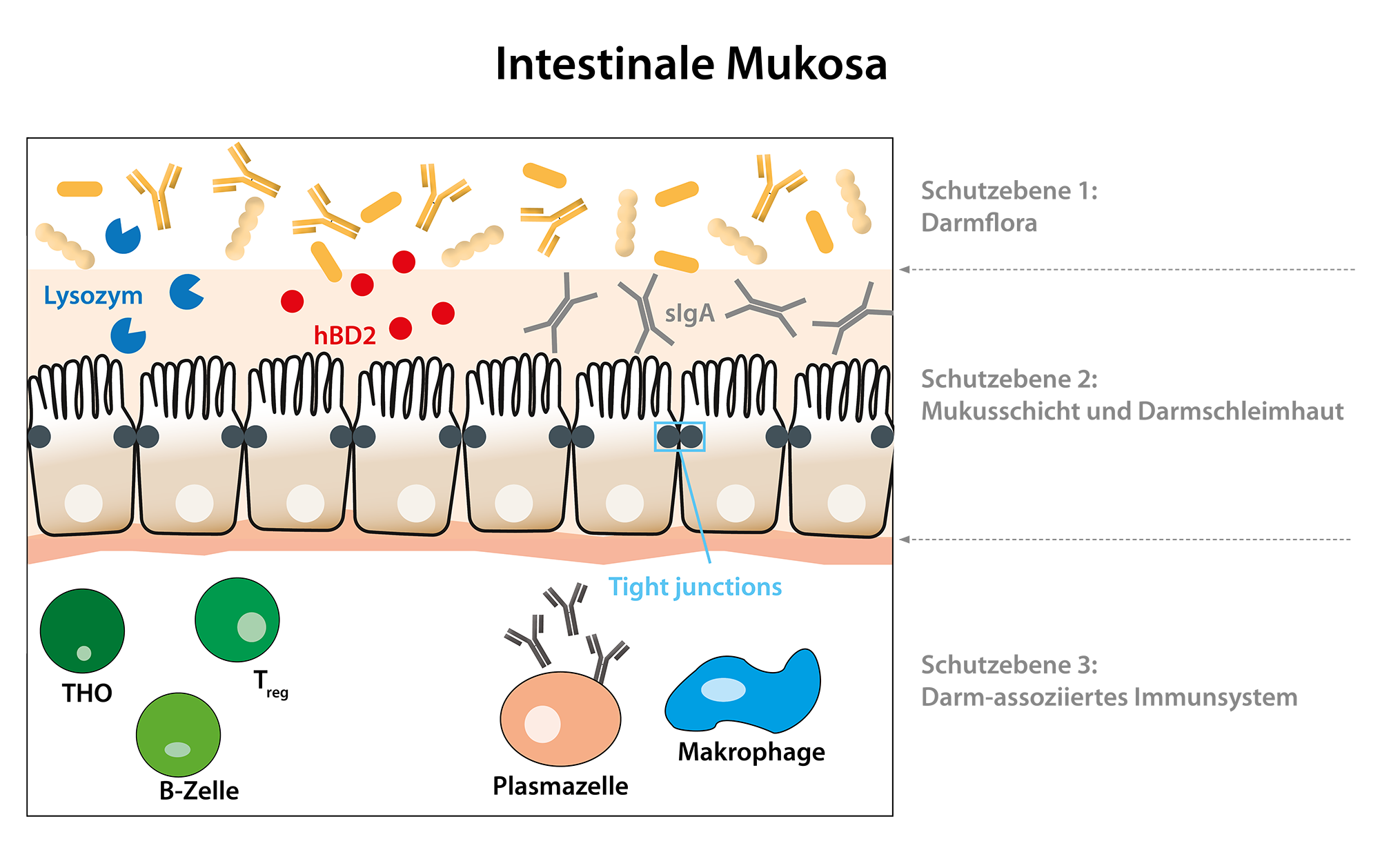
Mit Hilfe des breiten Produktportfolios der Immundiagnostik AG im Bereich Leaky Gut können sowohl über die epitheliale als auch über die immunologische Barriere des Darms Aussagen getroffen werden. Für die epitheliale Barriere hat sich primär der Biomarker Zonulin etabliert. Erhöhte Zonulin-Konzentrationen führen zu einer aktiven, aber auch reversiblen Öffnung der Tight Junctions. Die Immundiagnostik AG bietet zwei Zonulin ELISAs an: Zonulin für Stuhl (K 5600) und Zonulin für Serum (K 5601). Neben Zonulin ist der Biomarker α1-Antitrypsin ein passiver Marker für eine erhöhte Darmpermeabilität. α1-Antitrypsin ist ein Serumprotein und diffundiert durch Öffnungen in der Darmschleimhaut in das Lumen des Darms und kann dadurch in Stuhlproben nachgewiesen werden (K 6750, K 6760, K 6752). Eine Kombination der Biomarker Zonulin und α1-Antitrypsin ist empfehlenswert, da durch Schädigungen im Epithel niedrige Zonulin-Konzentrationen verursacht werden können. Dies würde zu einer falsch negativen Diagnose führen. FABP2 wird von strukturell geschädigten Darmepithelzellen passiv ausgeschüttet und kann in Blutproben nachgewiesen werden. Daher ist FABP2 ein Biomarker für eine starke Beeinträchtigung der Darmpermeabilität mit Epithelschäden (KR6809). Sowohl sIgA (K 8870, K 8880) als auch hBD2 (K 6500) treffen eine Aussage über die immunologische Barriere des Darms. Sind sIgA- und oder hBD2-Konzentrationen erniedrigt, ist die immunologische Barriere nicht funktionstüchtig, wodurch es zu einer erhöhten Darmpermeabilität kommen kann.
Die Parameter α1-Antitrypsin, sIgA und hBD2 können mit den IDK® Stuhlprobenaufbereitungsröhrchen (SAS) befüllt mit dem Extraktionspuffer IDK Extract® (K 6999) kombiniert werden. Für die Aufnahme einer definierten Probenmenge ist keine Probeneinwaage erforderlich. Durch das Einstechen des gelben Dosierstabs in die Stuhlprobe füllen sich die Vertiefungen an der Spitze des Stabs mit Stuhlprobe. Beim Einführen des Dosierstabs in das Stuhlprobenröhrchen wird überschüssiger Stuhl abgestreift, wodurch exakt 15 mg Stuhl in das Röhrchen gelangen. Die Verwendung des IDK® SAS ermöglicht einen minimalen Stuhlkontakt, spart Zeit und Kosten. Der im Stuhlprobenröhrchen enthaltene Extraktionspuffer IDK Extrakt® ermöglicht eine Lagerung des Stuhlprobenextrakts für 7 Tage bei -20°C, 2-8°C und Raumtemperatur. Das System ist ready-to-use und kann direkt für die manuelle als auch für die automatisierte Abarbeitung genutzt werden.


Referenzen:
・ Brandtzaeg, P. (1981). Transport models for secretory IgA and secretory IgM. Clin Exp Immunol, 44(2), 221-232. https://www.ncbi.nlm.nih.gov/pubmed/6118214
・ Ganz, T., & Lehrer, R. I. (1994). Defensins. Curr Opin Immunol, 6(4), 584-589. https://doi.org/10.1016/0952-7915(94)90145-7
・ Hill, C. P., Yee, J., Selsted, M. E., & Eisenberg, D. (1991). Crystal structure of defensin HNP-3, an amphiphilic dimer: mechanisms of membrane permeabilization. Science, 251(5000), 1481-1485. https://doi.org/10.1126/science.2006422
・ Strugnell, R. A., & Wijburg, O. L. (2010). The role of secretory antibodies in infection immunity. Nat Rev Microbiol, 8(9), 656-667. https://doi.org/10.1038/nrmicro2384