


In unserem ersten Blog Post (Part 1/3) der Reihe haben wir über den Aufbau der intestinalen Barriere und über Folgen einer erhöhten intestinalen Durchlässigkeit gesprochen. Die intestinale Barriere kann in drei Schutzebenen aufgeteilt werden: 1) Darmflora, 2) intestinale Mukosa und 3) darm-assoziiertes Immunsystem. Ist diese Barriere beeinträchtigt, kann es zu einer erhöhten Durchlässigkeit des Epithels kommen. Der Stofftransport durch das Epithel ist ein sehr stark regulierter Vorgang. In diesem Zusammenhang unterscheidet man in parazellulären bzw. transzellulären Stofftransport. Während es sich bei dem transzellulären Stofftransport um einen aktiven Transport von meist kleinen Molekülen durch die Epithelzellen hindurch handelt, ist der parazelluläre Transport hingegen eine passive Diffusion von größeren Molekülen zwischen den Epithelzellen. In der Regulation des parazellulären Transports spielen sogenannte Tight Junctions eine wichtige Rolle. Tight Junctions sind Proteincluster, die sich an den Membranen der Epithelzellen ausbilden und mit angrenzenden Epithelzellen interagieren. Durch die Interaktion zweier angrenzender Epithelzellen wird eine Diffusionsbarriere aufgebaut. Durch diese reversible Interaktion ist eine regulierte Stoffdiffusion durch Tight Junctions möglich.
Lactulose-Mannitol-Test – Goldstandard mit Limitierungen
Der Goldstandard in der Diagnose einer erhöhten Permeabilität des Darms ist der sogenannte Lactulose-Mannitol-Test. Das Prinzip des Tests beruht auf der Messung zweier wasserlöslicher Zucker im Urin nach deren enteraler Aufnahme. Das kleinere Zuckermolekül Mannitol wird transzellulär resorbiert, wohingegen das größere Disaccharid Lactulose parazellulär aufgenommen wird. Durch das Vorhandensein von funktionalen Tight Junctions werden unter physiologischen Bedingungen nur kleinste Mengen an Lactulose aufgenommen. Ist die Permeabilität im Darm erhöht, steigen Lactulose-Konzentrationen im Urin an und das Verhältnis zwischen Lactulose und Mannitol verschiebt sich. Diese Methode hat allerdings einige Limitierungen. So ist wissenschaftlich nicht gänzlich geklärt, ob beide Zucker unterschiedliche Transportwege benutzen. Weitere Probleme sind das Fehlen von allgemein akzeptierten Referenzwerten sowie eine fehlende standardisierte Durchführung in den Laboren. (Vanuytsel et al., 2021)
Neben dem Lactulose-Mannitol-Test haben sich weitere diagnostische Möglichkeiten im Zusammenhang mit einer erhöhten intestinalen Permeabilität etabliert.
Zonulin – der sensitive Nachweis eines durchlässigen Darms
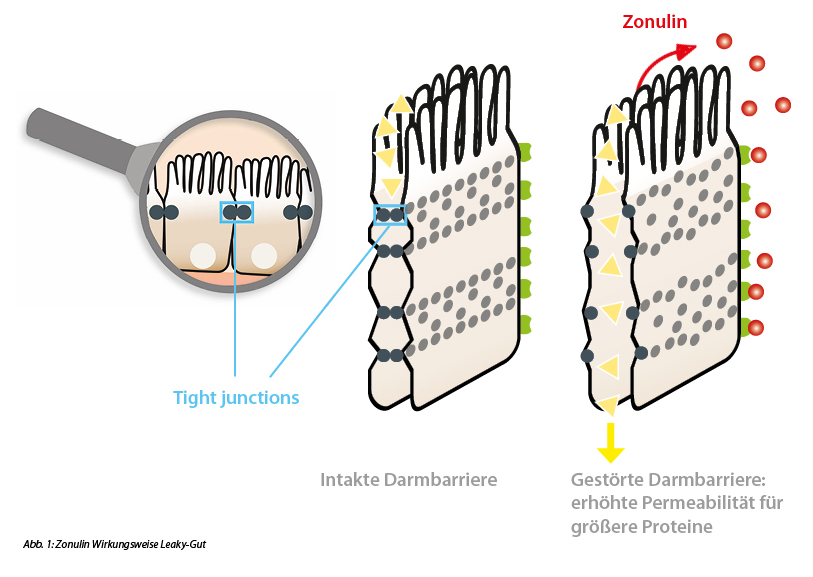
Ein weit verbreiteter Biomarker ist Zonulin. Zonulin ist ein humanes Protein ähnlich dem Zonula-occludens-Toxin von Vibrio cholerae, das an der Regulation der Tight Junctions in der Darmwand beteiligt ist. Zonulin bindet an einen spezifischen Rezeptor an der Oberfläche der Epithelzellen und aktiviert eine Kaskade biochemischer Ereignisse, welche die Öffnung der Tight Junctions induzieren und als Folge die Durchlässigkeit der Darmepithelzellen erhöhen, so dass verschiedene Substanzen die Darmbarriere passieren und Autoimmunreaktionen auslösen können. Die Messwerte des IDK® Zonulin ELISA (K 5600 Stuhl) bzw. IDK® Zonulin ELISA (K 5601 Serum), der Zonulin-Familien-Peptide nachweist, korrelieren – wie bereits in vielen Veröffentlichungen festgestellt – mit etablierten metabolischen Merkmalen, die mit einer erhöhten Darmpermeabilität wie Insulinresistenz und Adipositas zusammenhängen. (Fasano, 2011) (Mulak et al., 2019) (Caviglia et al., 2019)
α1-Antitrypsin – Permeabilitäts- und Entzündungsmarker
α1-Antitrypsin stellt einen Inhibitor von inflammatorischen Enzymen (Elastasen) dar. Als ein solcher Inhibitor wird α1-Antitrypsin bei inflammatorischen Prozessen freigesetzt, um die proteolytische Aktivität der Elastasen im Entzündungsbereich zu begrenzen. α1-Antitrypsin wird hauptsächlich in der Leber bzw. von intestinalen Makrophagen, Monozyten und Darmepithelzellen synthetisiert. Sein fäkaler Nachweis gilt als Marker für den intestinalen Eiweißverlust und eine erhöhte Schleimhautpermeabilität, da es aufgrund seiner antiproteolytischen Aktivität nur einem geringen intestinalen Abbau unterliegt und nahezu unverändert im Stuhl ausgeschieden wird. Darüber hinaus wird die Bestimmung der fäkalen α1-Antitrypsin-Konzentration zur Beurteilung der Aktivität chronisch-entzündlicher Darmerkrankungen herangezogen. Neben der Messung der einfachen 24h-α1-Antitrypsin Ausscheidung in Stuhlproben hat sich auch die α1-Antitrypsin-Clearence-Bestimmung im klinischen Alltag durchgesetzt (IDK® α1-Antitrypsin Clearance K 6752 – Quotient aus den α1-Antitrypsin-ELISA-Werten von Stuhl- und Serumproben). Der IDK® α1-Antitrypsin ELISA (K 6750) ist empfindlicher als andere gebräuchliche Nachweißmethoden und erkennt nicht nur hepatische sondern auch enterale α1-Antitrypsin-Formen. Unser ELISA stellt somit eine erfolgsversprechende Alternative für die breite Routineanwendung dar. Die Kombination zweier spezifischer Antikörper in unserem IDK® α1-Antitrypsin-ELISA schließt die Möglichkeit falsch negativer Befunde weitgehend aus und gewährleistet damit eine zuverlässige Diagnostik. (Faust et al., 2001)
FABP2 – Marker bei geschädigter Epithelschicht
FABP (fatty acid binding proteins) sind eine Gruppe von lipophilen Proteinen im Zytoplasma mit diversen Aufgaben, wie beispielsweise die Aufnahme und der Transport von langkettigen Fettsäuren oder Cholesterin. Das FABP2 wird ausschließlich im Zytoplasma von Darmepithelzellen synthetisiert und gilt daher als spezifischer Marker für diese Art von Zellen. Bei jeglicher struktureller Schädigung der Epithelzellen, wie sie beispielsweise bei fortgeschrittenem Leaky Gut auftritt, wird FABP2 passiv in den Blutkreislauf freigesetzt. Somit kann FABP2 in Blutproben als Biomarker für die Schädigung der intestinalen Epithelschicht genutzt werden (IDK® FABP2 ELISA KR6809). (Adriaanse et al., 2016)
Grundsätzlich empfiehlt sich die Kombination aller hier vorgestellten Biomarker zur Diagnose von erhöhter intestinaler Permeabilität. Zonulin im Stuhl ist in diesem Fall die sensitivste Variante. Ist die erhöhte Durchlässigkeit des Darms allerdings schon sehr weit fortgeschritten, kann es zu einer starken strukturellen Schädigung der Epithelschicht kommen. Dies kann dazu führen, dass niedrige Zonulin-Konzentrationen gemessen werden, da Zonulin von den Epithelzellen selbst synthetisiert und in den Darm sekretiert wird. Niedrige Zonulin-Konzentrationen mit gleichzeitig erhöhten α1-Antitrypsin- bzw. auch erhöhten FABP2-Konzentrationen weisen daher auf eine sehr starke Schädigung des Epithels hin.
In unserem nächsten Beitrag Part 3 erfahren Sie mehr über Diagnosemöglichkeiten der immunologischen Barriere des Darms im Zusammenhang mit Leaky Gut.
Referenzen:
・Adriaanse, M. P., Leffler, D. A., Kelly, C. P., Schuppan, D., Najarian, R. M., Goldsmith, J. D., Buurman, W. A., & Vreugdenhil, A. C. (2016). Serum I-FABP Detects Gluten Responsiveness in Adult Celiac Disease Patients on a Short-Term Gluten Challenge. Am J Gastroenterol, 111(7), 1014-1022. https://doi.org/10.1038/ajg.2016.162
・Caviglia, G. P., Dughera, F., Ribaldone, D. G., Rosso, C., Abate, M. L., Pellicano, R., Bresso, F., Smedile, A., Saracco, G. M., & Astegiano, M. (2019). Serum zonulin in patients with inflammatory bowel disease: a pilot study. Minerva Med, 110(2), 95-100. https://doi.org/10.23736/S0026-4806.18.05787-7
・Fasano, A. (2011). Zonulin and its regulation of intestinal barrier function: the biological door to inflammation, autoimmunity, and cancer. Physiol Rev, 91(1), 151-175. https://doi.org/10.1152/physrev.00003.2008
・Faust, D., Spirchez, Z., Armbruster, F. P., & Stein, J. (2001). Determination of alpha1-proteinase inhibitor by a new enzyme linked immunosorbant assay in feces, serum and an enterocyte-like cell line. Z Gastroenterol, 39(9), 769-774. https://doi.org/10.1055/s-2001-17194
・Mulak, A., Koszewicz, M., Panek-Jeziorna, M., Koziorowska-Gawron, E., & Budrewicz, S. (2019). Fecal Calprotectin as a Marker of the Gut Immune System Activation Is Elevated in Parkinson's Disease. Front Neurosci, 13, 992. https://doi.org/10.3389/fnins.2019.00992
・Vanuytsel, T., Tack, J., & Farre, R. (2021). The Role of Intestinal Permeability in Gastrointestinal Disorders and Current Methods of Evaluation. Front Nutr, 8, 717925. https://doi.org/10.3389/fnut.2021.717925